解析事例 > 分子病態解析での使用例
1. 立体構造データを入手する
まず、対象となる立体構造データをProtein Data Bankより入手します。今回は、ヒトHexosaminidase A (HexA)の立体構造を使用します。PDB IDは2GK1です。ここでは、Chain Aのαサブユニットを使用します。
PDBからの立体構造データのダウンロードについてはこちらをご参照ください。
分子病態解析での使用例 Tay-Sachs病の変異による立体構造への影響 (1)
2. 立体構造上の変異の位置
-
(1)立体構造を表示して、変異の起こった残基の位置を確認します。
-
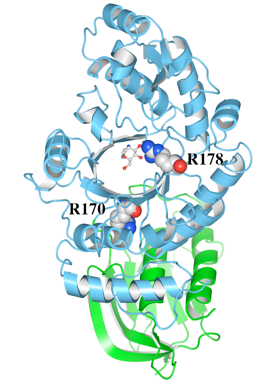
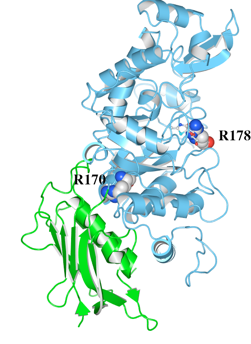
(2)Waalsを使用して、HexAのαサブユニットの立体構造上で、ミスセンス変異が見られた170番目のアルギニン(R170)及び178番目のアルギニン(R178)の位置をマップしました。図1は正面から、図2は側面から表示したものです。
-
(3)HexA αサブユニットにはN末端側のドメインIと、C末端側のドメインIIの2つのドメインが存在します。ここでは、基本表示でCartoonsのStyleをRibbonsにし、指定表示でドメインIをGreenにドメインIIをCyanに、R170及びR178をSpace-fillingで示しています。
-
(4)R170はドメインIIに存在し、ドメインIの近くであることがわかります。また、R178は、ドメインIIの基質結合ポケットに存在することがわかります。
ミスセンス変異が見つかった場合、立体構造を使ってどのようなことが調べられるでしょうか。
対象となる蛋白質の立体構造が決まっていれば、変異が起こったアミノ酸残基の立体構造上の位置や周辺構造を調べて、残基の役割や活性中心や機能部位に近いかどうかなど考察することができます。また、変異体の立体構造モデルを作成して元の構造と比較することにより、変異による立体構造への影響を推測できる場合があります。
ここでは、Hexosaminidase Aの変異(Tay-Sachs病)による立体構造への影響をSWIS-MODELとWaalsを使用して解析した例をご紹介します。
図1 変異が起こったアミノ酸残基の位置(正面)
-
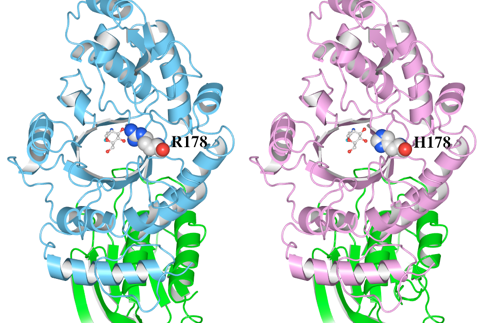
4.変異体モデルの作成
変異による立体構造への影響を見るため、変異体モデルを作成します。
-
(1)野生型HexAの立体構造をテンプレート構造として、R170をHに置換したモデル構造及びR178をHに置換したモデル構造を作成します。
-
(2)ここでは、SWISS-MODELのAutomated Modeを使用して、変異体モデルを作成しました。
図4HexAにおけるR178と基質アナログの距離

解析事例
SWISS MODELについてこちらで紹介しています。
3. 変異が起こったアミノ酸残基の立体構造での役割
-
(1)変異が起こったR170及びR178の近傍の様子を確認します。
-
(2)R170の側鎖は、ドメインIとドメインIIの間に存在しています。ここでは、R170と近傍の残基の相互作用を調べました。R170の窒素原子から、球ピック機能を使って、2.8Å以内の原子を検出しました(図3)。その結果、R170では4つの酸素原子が検出され、4つの水素結合を持つことが推測されました。そのうちの2つはドメインIに存在する残基でした。
-
(3)次に、R178について調べます。R178の側鎖は基質結合のポケットの内側に向いており、基質結合に寄与している残基とされています。距離測定ツールで基質アナログであるリガンドNGTとの距離を測定したところ、R178の側鎖の窒素原子の2つがNGTの酸素との間に水素結合可能な距離にあり、R178の残基がリガンドと水素結合していることが確認できます。
図2 変異が起こったアミノ酸残基の位置(側面)
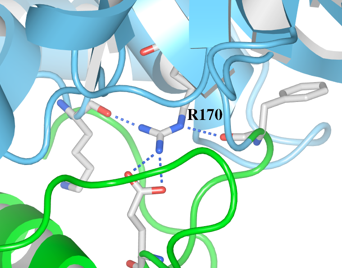
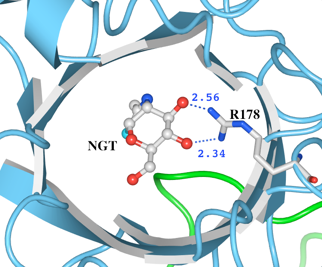
図3HexAにおけるR170と近傍残基との結合
1
次のページでは、作成した変異体モデルと野生型を比較し、変異による立体構造への影響を調べます。
分子病態解析での使用例 変異による立体構造への影響を調べる
ダイマーインタフェースを抽出する β-Hexosaminidase Bの例
PDBデータの向きを揃える Protein Kinase Aの例1
阻害剤との結合様式を比較する Protein Kinase Aの例2
コンフォメーション変化を見る EF-Tuの例
阻害剤との相互作用を調べる PP1と阻害剤Calyculinの例
Bファクターで比較する α-Galactosidaseの例
Copyright © 2009-2025 Altif Laboratories Inc. All rights reserved.