解析事例 > 分子病態解析での使用例
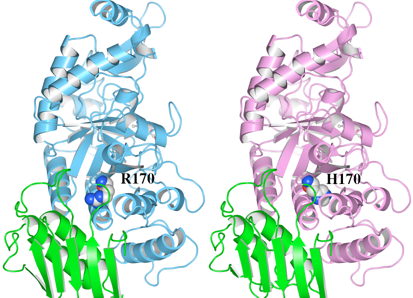
1. R170Hによる立体構造の変化 近傍残基との水素結合の消失
-
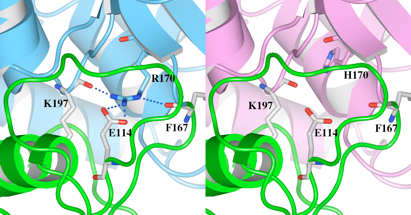
(1)野生型の立体構造(左)とR170H変異体モデルの立体構造(右)をWaalsで表示したものを図5に示します。R170及びH170をSpace-fillingで示しています。野生型のR170はドメインI(Green)とドメインII(Cyan)の間に存在していることがわかります。
-
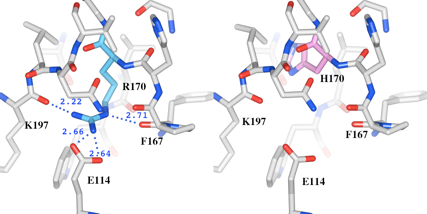
(2)次に、着目するR170とH170と水素結合可能な残基を検出しました。予め、それぞれの残基のCαから8.0Å以内に存在するアミノ酸残基を球ピック機能とWorkspace機能を使って近傍残基を絞り込みます。その後、球状距離測定ツールを使って、それぞれの残基の窒素原子から、2.9Å以内の原子を検出しました(図6)。その結果、R170では4つの酸素原子が検出され、4つの水素結合を持つと推測されました。一方、変異体モデルのH170の窒素原子からは、2.9Å以内の原子は1つも検出されませんでした。
-
(3)図7では、水素結合していると推測される残基のみ側鎖を表示し、全体構造をリボンで表示しています。野生型のR170は、隣のドメインIに存在するE114, F167を含む周辺残基と4つの水素結合を形成していますが、R170H変異体モデルのH170は水素結合を形成していません。
分子病態解析での使用例 Tay-Sachs病の変異による立体構造への影響 (2)
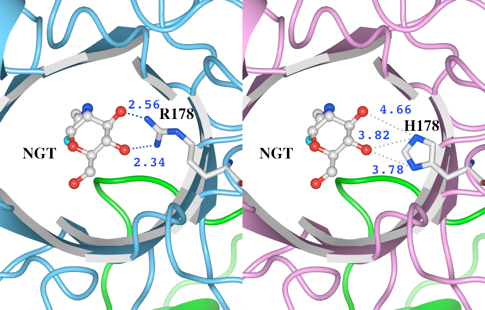
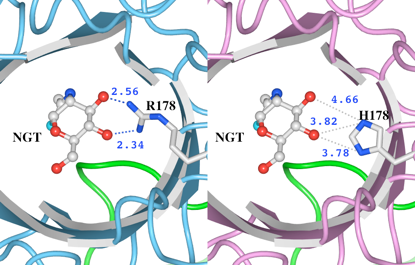
4. R178Hによる立体構造の変化 リガンドとの水素結合の消失
-
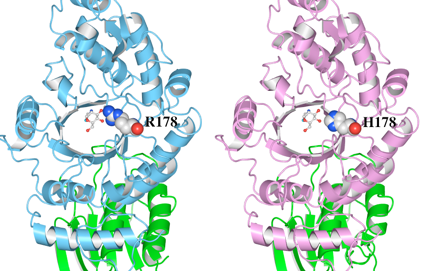
(1)野生型の立体構造(左)とR178H変異体モデルの立体構造(右)をWaalsで表示したものを図8に示します。R178及びH178をSpace-fillingで示しています。
-
(2)次に、変異があったR178とH178のアミノ酸残基とリガンドの結合について調べました(図9)。距離測定ツールで測定したところ、 野生型(左) のR178の側鎖の窒素原子の2つは、リガンドの酸素と水素結合可能な距離(2.56Åと2.34Å)に存在していることがわかります。野生型では、R178とリガンドの間のこれらの水素結合によって基質を結合していると考えられます。一方、H178に置換された変異体モデル(右)では、リガンドの酸素とH178の間の距離はいずれも3.7Å以上あります。この結果より、リガンドとの水素結合が消失していることが推測されました。
Hexosaminidase Aの変異(Tay-Sachs病)による立体構造への影響をSWIS-MODELとWaalsを使用して解析した例をご紹介します。作成した変異体モデルと野生型の立体構造を比較したところ、170番目のアルギニンがヒスチジンに変異した例R170Hでは、周辺構造の水素結合が消失し、タンパク質の安定性がなくなること、178番目のアルギニンがヒスチジンに変異した例R178Hでは、基質アナログであるリガンドとの水素結合が消失し、基質との結合が弱くなることが推測されました。
図5 HexA αサブユニットの野生型とR170H変異体モデルの立体構造
図6 変異が起こったR170及びH170の近傍の残基(8.0Å以内)
図7 変異が起こったR170と水素結合している残基とH170との比較
図9 変異が起こったR178及びH178とリガンドとの距離
図6
図8 HexA αサブユニットの野生型とR178H変異体モデルの立体構造

解析事例
野生型の立体構造と変異体モデルの立体構造の比較
野生型のHexAの立体構造とSWISS-MODELにより作成したモデル(前ページ参照)をWaalsを使って比較し、変異よる立体構造への影響を調べました。
2. R170Hによる立体構造への影響 構造の不安定化
R170は4つの水素結合を形成し、そのうちの3つはドメインIに存在する残基との結合でした。特にドメインIの114番目のグルタミン酸(E114)との静電結合は、ドメイン間の結合に寄与していると考えられます。R170からH170のアミノ酸置換により、野生型では4つあったこれらの結合が1つもなくなっていることが推測され、この変異により周辺構造の不安定化及びドメイン間の結合の消失による不安定化が起こる恐れが示唆されます。
5. R178Hによる立体構造への影響 基質結合能の低下
この結果より、本変異は、基質アナログであるリガンドとの水素結合を消失させ、基質との結合能に影響を及ぼすことが示唆されました。また、本変異による周辺のアミノ酸残基への影響は見られませんでした。
これら2つの変異は、どちらもアルギニンからヒスチジンへの変異であり、アミノ酸配列上の位置は8残基しか違いませんが、推測された立体構造に及ぼす影響は大きく異なります。以上のように、ミスセンス変異による一残基の置換について、立体構造の詳細を調べることで、変異の影響と実験結果を照らし合わせて考察することができると思われます。
今回ご紹介した例は、参考文献中で行った解析と同様の解析をWaalsとSWISS-MODELを使用して行ったものです。SWISS-MODELにより得られるモデル構造は、X線結晶構造解析やNMRによる解析とは異なり推測された構造ですので、慎重に扱う必要があります。また、ホモロジーモデリングでは、大きなコンフォメーション変化を予測することはできません。モデル構造と野生型の構造を比較しても、変異の影響が見つからない場合もあります。それらの点を考慮しても、立体構造を使って考察できるのは大きな魅力です。解析手法の一つとして参考にして頂ければ幸いです。
参考文献
Structural basis of the GM2 gangliosidosis B variant.
Matsuzawa F, Aikawa S, Sakuraba H, Lan HT, Tanaka A, Ohno K, Sugimoto Y, Ninomiya H, Doi H. J Hum Genet. 2003;48:582-9.
SWISS-MODEL
The SWISS-MODEL Workspace: A web-based environment for protein structure homology modelling.
Arnold K., Bordoli L., Kopp J., and Schwede T. Bioinformatics 2006; 22:195-201.
SWISS-MODEL: an automated protein homology-modeling server.
Schwede T, Kopp J, Guex N, and Peitsch MC Nucleic Acids Research 2003;31: 3381-3385.
SWISS-MODEL and the Swiss-PdbViewer: An environment for comparative protein modelling.
Guex, N. and Peitsch, M. C. Electrophoresis 1997;18: 2714-2723.
2
分子病態解析での使用例 変異による立体構造への影響を調べる
ダイマーインタフェースを抽出する β-Hexosaminidase Bの例
PDBデータの向きを揃える Protein Kinase Aの例1
阻害剤との結合様式を比較する Protein Kinase Aの例2
コンフォメーション変化を見る EF-Tuの例
阻害剤との相互作用を調べる PP1と阻害剤Calyculinの例
Bファクターで比較する α-Galactosidaseの例
研究対象の蛋白質やDNA、RNAをWaalsで解析しませんか? ご質問やご相談などございましたら、お気軽にメールにてご連絡ください。
-
3.実験結果との関連
本変異を持つ患者の細胞では、成熟型HexA αサブユニットの量が減少していることがWestern blottingにより確認され、変異による構造の不安定化と関連づけられました。
-
6. 実験結果との関連
変異による周辺残基への影響は見られず、基質との結合能に影響を及ぼすという結果は、本変異を持つ変異体タンパク質が、残存活性はあるものの、Km値が30倍増大する実験結果を支持していると考えられました。
Copyright © 2009-2013 Altif Laboratories Inc. All rights reserved.